A
Escala de Pauling foi definida por Linus Pauling e tem a função de medir a eletronegatividade dos elementos químicos.
A
eletronegatividade está relacionada à atratividade dos átomos e moléculas, ou seja, ao potencial que estes possuem de atrair elétrons.
Na tabela periódica,
a eletronegatividade aumenta da esquerda para a direita e de baixo para
cima, ou seja, conforme os períodos aumentam, maior é o número de
camadas da eletrosfera
dos elementos e, portanto, maior o seu raio, o que influencia
diretamente na sua eletronegatividade, já que haverá uma aproximação
menor entre os elétrons a serem compartilhados e o núcleo do átomo, que
exerce o ponto de atração.
Assim, o elemento mais eletronegativo é o flúor. A ordem de polaridade é, portanto:
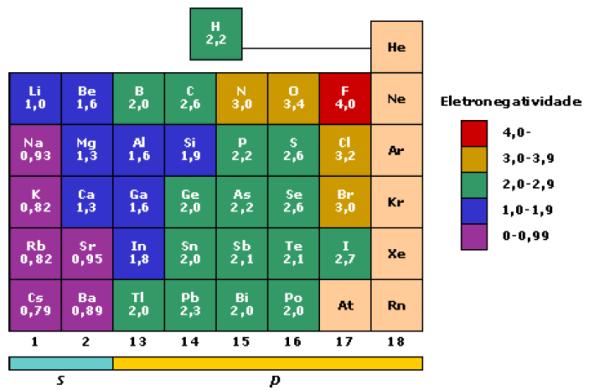
F > O > N > Cl > Br > I > S > C > P > H
A eletronegatividade influencia na ligação entre os átomos, já que haverá a possibilidade de maior ou menor atração.
O átomo com mais eletronegatividade atrai para si mais elétrons. A
diferença de eletronegatividade entre os elementos determina se a
ligação será polar ou apolar. Se a diferença de eletronegatividade for
igual a zero, a ligação será apolar, do contrário a ligação será polar.
A polaridade das ligações químicas explica fatores como o fato de água
e óleo não se misturarem. Em razão da polaridade das moléculas da água,
uma das ligações mais fortes conhecidas, o óleo permanece em sua
superfície, já que, para que pudesse imiscuir-se na água seria
necessário o fornecimento de uma quantidade razoável de energia para
“quebrar” suas moléculas ou, ainda, que sua ligação fosse, também,
polar, o que não ocorre, já que as ligações químicas de óleos e gorduras
são apolares. Além disso, os hidrocarbonetos, moléculas formadas por hidrogênio e Carbono, muitos deles derivados do petróleo, são, também, apolares.
Uma substância polar pode imiscuir-se numa substância polar, da mesma
forma que as substâncias apolares podem imiscuir-se entre si.
A eletronegatividade está, portanto, relacionada à força para rompimento de ligações químicas das moléculas.
Numa ligação química, o átomo com maior eletronegatividade, ao atrair os
elétrons, fica com a carga negativa. Por outro lado, os átomos com
menor eletronegatividade perdem elétrons e, em razão disso, adquirem uma
carga positiva.
Além do raio atômico,
outro fator que influencia a eletronegatividade é o número de elétrons
que o átomo possui em sua última camada. Quanto maior o número de
elétrons, mais o átomo deseja atrair elétrons externos para alcançar a
estabilidade (8 elétrons na última camada). Porém, tal fator não deve
ser considerado como único critério, já que demonstrações práticas
sugerem que o cloro,
que possui 7 elétrons na camada de valência, é menos eletronegativo que
o Oxigênio, que possui 6 elétrons na camada de valência.
Isso ocorre porque o Oxigênio é consideravelmente menor do que o
Cloro, ou seja, seu núcleo está mais próximo dos elétrons externos e
exerce uma atração mais forte sobre eles.
Através da
Escala de Pauling, é possível prever a característica das ligações químicas e algumas das propriedades das misturas.